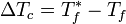Cuando se prepara una solución con un solvente y un soluto no volátil (que se transformará en gas) y se mide su presión, al compararla con la presión de vapor de su solvente puro (medidas a la misma temperatura), se observa que la de la solución es menor que la del solvente. Esto es consecuencia de la presencia del soluto no volátil.
A su vez, cuando se las comparan las presiones de vapor de dos soluciones de igual composición y diferente concentración, aquella solución más concentrada tiene menor presión de vapor. El descenso de ésta se produce por dos razones: por probabilidad, pues es menos probable que existan moléculas de disolvente en el límite de cambio, y por cohesión, pues las moléculas de soluto atraen a las de disolvente por lo que cuesta más el cambio.
La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil.
Este efecto es el resultado de dos factores:
- La disminución del número de moléculas del disolvente en la superficie libre.
- La aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor.
___________________________________________________________________
EJEMPLOS
a un mol de azucar, se le añade 19 moles de agua a 30°C si la presión de vapor del H2O es 31.51 mmHg
¿Cuál será la presión de vapor de la mezcla?
X2=n soluto/n soluto+n disolvente=1/1+19=1/20=0.05
P1=P1°-Ap
AP=X2P1° P1=31.51mmHg-1.57 mmHg
=0.05(31.51mmHg)
Ap=1.57mHg =29.93mmHg
calcular la presión de vapor de una disulución preparada al disolver 218g de glucosa en 460 mL de agua a 30°C
Glucosa PM=180g/mol H2OPM=18
180g_______1 mol 118g___1 mol
218g______X =1.21mol 460g___X=25.55
X2=n soluto/n soluto + disolvente=1.21/26.76=0.0452
(0.0452)(31.51mmHg) P1=30.06 mmHg
=1.41795-31.51mmHg AP=1.42mmHg
P1=30.09mmHg
calcule la presión de vapor de una disolición preparada al disolver 82.4 g de urea(PM 60) en 212 mL de H2O a 35°C(42.18 mmHg)
1 mol _____60g
X_________82.4g
X=1.3733
X2=n soluto/n soluto de solvente= 1.3733/2.69883=0.5088
(0.5088)(42.18 mmHg)=21.4611
21.4611mmHg-42.18mmHg=20.719