Todas las disoluciones en las que, al enfriarse, el disolvente solidifica puro sin el soluto, tienen una temperatura de congelación inferior al disolvente puro. La magnitud del descenso crioscópico, ∆Tc, viene dada por la diferencia de temperaturas de congelación (o de fusión) del disolvente puro y de la disolución, Tf* y Tf, respectivamente:
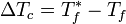
La aplicación del descenso crioscópico fue esencial para el estudio de las propiedades de las sustancias, ya que permitió la determinación de sus masas moleculares de forma precisa. También fue fundamental para la confirmación de la teoría de la disociación electrolítica de Arrhenius y para la determinación de coeficientes de actividad.
El descenso crioscópico ha encontrado aplicaciones prácticas fuera de los laboratorios de investigación, como en el uso de anticongelantes para evitar que los circuitos de refrigeración de los motores de los vehículos o los mismos combustibles se congelen cuando las temperaturas bajan en invierno, para la determinación de la adulteración de la leche con agua, para la preparación de disoluciones en la industria farmacéutica, para análisis clínicos de sangre y orina, etc.

_____________________________________________________________________________
BIBLIOGRAFIA
http://quimicautnfrt.galeon.com/TemaN7.htm
No hay comentarios:
Publicar un comentario