Punto de ebullición, temperatura a la que la presión de vapor de un líquido se iguala a la presión atmosférica existente sobre dicho líquido. A temperaturas inferiores al punto de ebullición (p.e.), la evaporación tiene lugar únicamente en la superficie del líquido. Durante la ebullición se forma vapor en el interior del líquido, que sale a la superficie en forma de burbujas, con el característico hervor tumultuoso de la ebullición. Cuando el líquido es una sustancia simple o una mezcla azeotrópica, continúa hirviendo mientras se le aporte calor, sin aumentar la temperatura; esto quiere decir que la ebullición se produce a una temperatura y presión constantes con independencia de la cantidad de calor aplicada al líquido.
Cuando se aumenta la presión sobre un líquido, el p.e. aumenta. El agua, sometida a una presión de 1 atmósfera (101.325 pascales), hierve a 100 °C, pero a una presión de 217 atmósferas el p.e. alcanza su valor máximo, 374 °C. Por encima de esta temperatura, (la temperatura crítica del agua) el agua en estado líquido es idéntica al vapor saturado.
Al reducir la presión sobre un líquido, baja el valor del p.e. A mayores alturas, donde la presión es menor, el agua hierve por debajo de 100 °C. Si la presión sobre una muestra de agua desciende a 6 pascales, la ebullición tendrá lugar a 0 °C.
Los puntos de ebullición se dan dentro de un amplio margen de temperaturas. El p.e. más bajo es el del helio, -268,9 °C; el más alto es probablemente el del volframio, unos 5.900 °C. Los puntos de ebullición correspondientes a los distintos elementos y compuestos que se citan en sus respectivos artículos, se refieren a la presión atmosférica normal, a no ser que se especifique otra distinta.
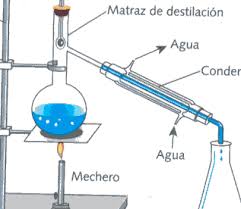
________
______________________________________________________________
BIBLIOGRAFÍA
Microsoft ® Encarta ® 2008. © 1993--2007 Microsoft Corporation. Reservados todos los derechos.
ejemplos
Una solución consiste de 7.5g de un soluto orgánico en 75g de CCl4, ebulle a 89°C ¿Cuál es el peso molecular del soluto?
TebCCl4=76.8°C
Ateb=Keb.m 89°C
Keb 5.02°C/mol/kg
ATeb=Tebsoln-Tebdisol v=89°C-76.8°C=12.2=ATeb
Ateb=Keb m
m=Ateb/Keb=12.2°C/5.02°C/mol/kg= 2.43 mol/kg
PM= 7.5g/0.0182=0.18 moles
No hay comentarios:
Publicar un comentario